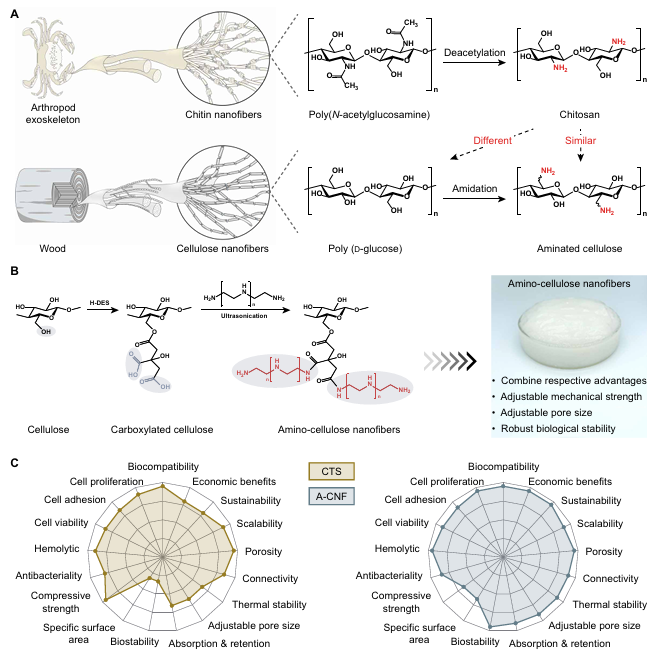
随着对可持续材料的需求日益增长,利用可再生资源开发先进生物材料已成为研究热点。纤维素纳米纤维源自丰富的天然资源,具备优异的机械强度和热稳定性,但其固有的生物功能性不足限制了应用范围。 与此同时,壳聚糖作为纤维素的阳离子类似物,虽具有生物相容性和抗菌活性,却因结晶度低、机械性能弱及加工条件苛刻而难以在要求严苛的环境中应用。因此,如何将纤维素的力学优势与壳聚糖的生物功能结合,成为当前生物材料领域的一项关键挑战。
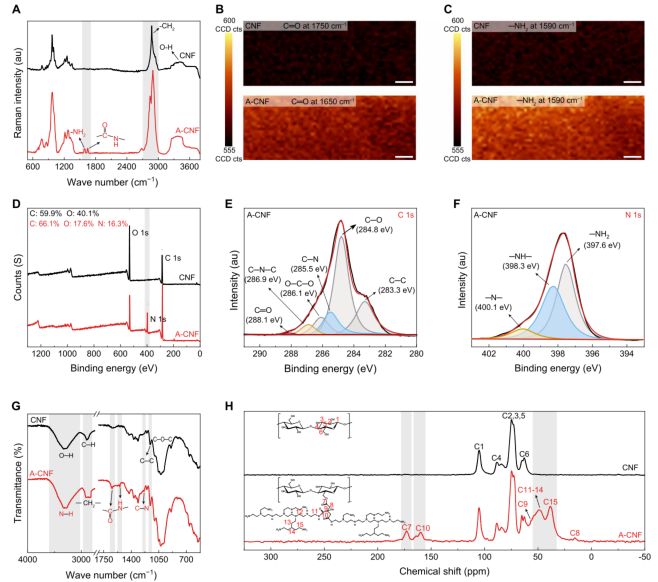
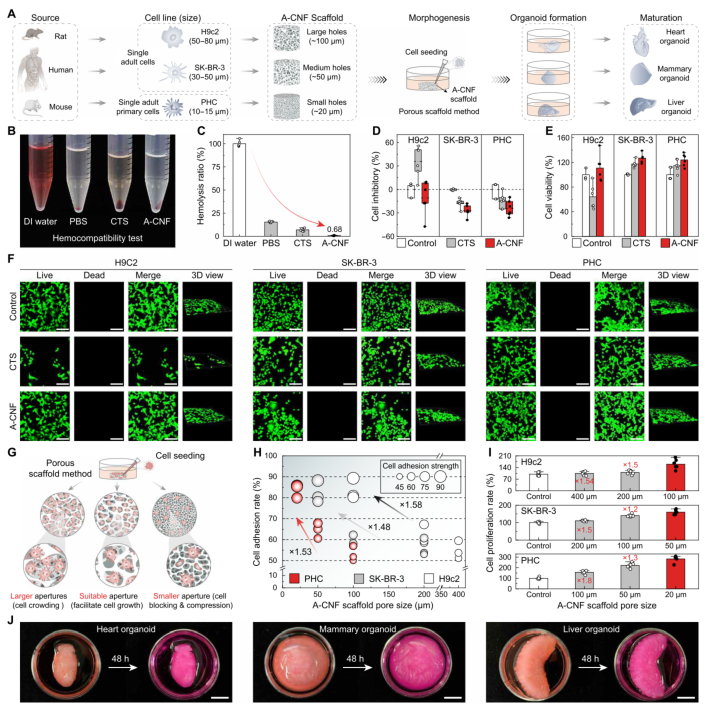
近日,东北林业大学于海鹏教授、陈文帅教授和德州大学奥斯汀分校余桂华教授合作提出了一种绿色、低成本、可规模化制备氨基纤维素纳米纤维的新方法。该方法通过将羧基和氨基接枝到纤维素上,并经过超声纳米纤化处理,成功制备出超细、高长径比的A-CNF材料。该材料不仅机械性能增强,还具备优异的生物相容性和抗菌活性。研究显示,A-CNF支架在组织工程中表现出良好的生物稳定性、孔隙连通性和机械完整性,细胞活力显著提升,溶血率降低,展现出作为生物医学材料的广阔潜力。相关论文以“Sustainable synthesis of amino-cellulose nanofibers for biomaterial platforms”为题,发表在Science Advances上。 研究团队以大规模生产的纤维素浆粕为原料,采用由柠檬酸、氯化胆碱和水组成的低共熔溶剂进行预处理,促进纤维素表面羧基化。随后,通过与多种胺类化合物进行酰胺化反应,成功引入氨基官能团。在最优条件下(羧化纤维素与聚乙烯亚胺摩尔比为1:2),制备出的A-CNF具有高达2200的长径比,胺含量达6.18 mmol/g,氮含量为17.14%,zeta电位为+38.66 mV,取代度为0.22,产率超过95%。这些指标显著优于现有文献报道的同类材料。A-CNF悬浮液在储存8个月后仍保持均匀稳定,中试生产也证明其具备吨级扩产能力。 经济与环境效益分析显示,该合成路径的成本远低于传统的季铵化反应、酰胺化反应及商业壳聚糖的生产成本。生命周期评估进一步表明,该方法在全球变暖、陆地酸化和生态毒性等多项环境指标上均优于对比工艺,例如全球变暖潜能比传统壳聚糖合成降低了67.7%,凸显其绿色可持续优势。 图1. 纤维素向A-CNF的转化过程 (A)来自木材的纤维素与来自甲壳动物外骨骼的壳聚糖(CTS)的层次结构与化学结构对比,展示了多样的自然资源和有利于材料创新的复杂结构。 (B)A-CNF合成过程中的共价表面功能化步骤,详细说明了在纤维素纳米纤维上引入氨基的化学修饰过程。 (C)CTS与A-CNF在多项理化性质与生物活性上的雷达图对比,各项指标(如机械强度、热稳定性、生物相容性等)均已相对于观测最大值进行归一化处理。 图2. A-CNF的形态与理化性质分析 形态表征:(A)0.2% (w/v) A-CNF悬浮液(羧化纤维素:PEI摩尔比1:1)的数码照片;(B)原子力显微镜图像;(C、D)不同放大倍率的透射电子显微镜图像;(E)直径分布直方图;(F)0.2% (w/v) A-CNF悬浮液(羧化纤维素:PEI摩尔比1:2)的数码照片;(G)原子力显微镜图像;(H、I)不同放大倍率的透射电子显微镜图像;(J)直径分布直方图;(K)高长径比A-CNF的透射电子显微镜图像。 理化性质:(L)最优条件下制备的A-CNF与文献值的纵横比对比;(N)最优条件下制备的A-CNF与文献值的胺含量对比。 定量分析:(M)基于三次独立测量的A-CNF胺含量比较。 稳定性与可扩展性评估:(O)A-CNF悬浮液储存8个月前后的照片;(P)1 wt% A-CNF的中试生产测试,展示了生产过程的规模化能力。 生命周期与技经分析:(Q)A-CNF合成成本分解及与季铵化、酰胺化反应和商业CTS每吨成本的对比;(R)A-CNF与CTS生产在10项环境指标(包括全球变暖、人类健康、陆地生态系统等)上的影响对比。 光谱分析结果证实了A-CNF的成功合成。拉曼光谱在1500 cm⁻¹和1650 cm⁻¹处出现新吸收峰,分别对应氨基和酰胺基团;X射线光电子能谱显示碳、氮、氧含量分别为66.1%、16.3%和17.6%,并检测到C–N–C和C–N键的存在;傅里叶变换红外光谱中N–H伸缩振动信号增强,羧酸盐C=O峰消失,进一步支持了表面酰胺化的完成。X射线衍射与固态13C核磁共振结果也表明,纤维素I型晶体结构在修饰后得以保留,同时出现了由聚乙烯亚胺接枝引起的新碳信号。 图3. A-CNF的光谱分析 (A)CNF与A-CNF的拉曼光谱;(B)羰基(C=O)与(C)氨基(NH₂)的拉曼光谱细节,通过颜色强度展示酰胺与氨基在A-CNF中的分布;(D)CNF与A-CNF的XPS谱图;(E、F)A-CNF的C 1s与N 1s谱图;(G)所有样品的FTIR光谱对比;(H)CNF与A-CNF的固态13C NMR谱图对比。 A-CNF支架展现出高度可调的物理结构与性能。通过调节A-CNF固含量(1–10 wt%),可实现孔径从540 μm至20 μm的精确调控,满足不同细胞尺寸的需求。支架具有高比表面积(17.84–22.51 m²/g)、优异的孔隙连通性(闭合孔数量仅为壳聚糖支架的1/14至1/21)和持续高于95%的生物稳定性,远优于壳聚糖支架(12小时内完全降解)。此外,A-CNF支架的水吸收率和持水率分别为壳聚糖支架的6–32倍和4–11倍,为细胞提供了理想的湿润微环境。 在抗菌性能方面,A-CNF对大肠杆菌和金黄色葡萄球菌的杀菌率分别达到81.8%和92.3%,其机制包括破坏细菌膜结构和干扰细胞壁合成。机械性能方面,A-CNF支架的压缩强度可从0.3 MPa调整至8.6 MPa,杨氏模量覆盖0.003–0.51 MPa,能够匹配从软组织(如脑、肝)到硬组织(如骨)的力学需求,并通过浇铸成型成功制备出心、脑、肺、肾等多种器官模型。 图4. A-CNF支架的可定制性能 (A)不同固含量A-CNF支架的截面示意图与扫描电镜图像,插图为各支架的数码照片; (B)Micro-CT重建的三维图像展示A-CNF支架内部的孔隙结构; (C)比表面积与孔径随支架固含量的变化; (D)A-CNF与CTS支架内部孔隙连通性分析; (E)不同固含量下A-CNF与CTS支架的孔隙率与密度对比; (F)A-CNF与CTS支架的水吸收与持水能力图示; (G)A-CNF与CTS支架在不同固含量下的生物稳定性比较,附随时间变化的数码照片记录; (H)A-CNF支架对大肠杆菌和金黄色葡萄球菌的抗菌抑制率; (I)固含量对A-CNF支架压缩强度与杨氏模量的影响; (J)A-CNF支架与四种文献报道支架在压缩强度与比强度上的Ashby图对比; (K)A-CNF支架杨氏模量与天然体内组织刚度范围的比较; (L)通过凝胶浇铸制备的仿生软组织形态A-CNF支架。 生物学评价进一步验证了A-CNF支架的优越性。溶血率仅为0.68%,远低于5%的安全阈值。使用H9c2、SK-BR-3和PHC三种细胞系进行的实验表明,A-CNF支架能显著提升细胞活力与增殖率,抑制率为负值,细胞存活率超过110%。通过匹配细胞尺寸与支架孔径(如100 μm用于心肌细胞,50 μm用于乳腺腺癌细胞,20 μm用于肝细胞),A-CNF有效促进了细胞粘附与器官样结构的形成,在48小时内成功支持了心脏、乳腺和肝脏类器官的发育。 图5. A-CNF支架的生物学性能 (A)A-CNF支架用于类器官培养的示意图,显示其可调孔径适应不同细胞尺寸; (B)CTS与A-CNF支架的溶血测试结果图像; (C)各支架组的溶血率定量; (D)CCK-8法测定的细胞抑制率; (E)细胞在A-CNF支架上培养24小时后的活力分析; (F)H9c2、SK-BR-3与PHC细胞在CTS与A-CNF支架上培养48小时后的共聚焦与三维荧光图像; (G)支架孔径对细胞行为影响的示意图; (H、I)不同孔径A-CNF支架上H9c2、SK-BR-3与PHC细胞的粘附率与增殖率; (J)心脏、乳腺与肝脏类器官在A-CNF支架中培养48小时后的数码照片。 综上所述,该研究不仅成功开发出一种兼具高强度、高生物活性与绿色可持续特性的氨基纤维素纳米纤维材料,还通过系统的结构与功能验证,展示了其在组织工程、抗菌敷料、药物递送等领域的广泛应用前景。未来,研究人员将进一步探索A-CNF的长期体内生物相容性、降解动力学及其免疫响应行为,推动这一创新材料向下一代医疗器械与再生治疗产品转化。