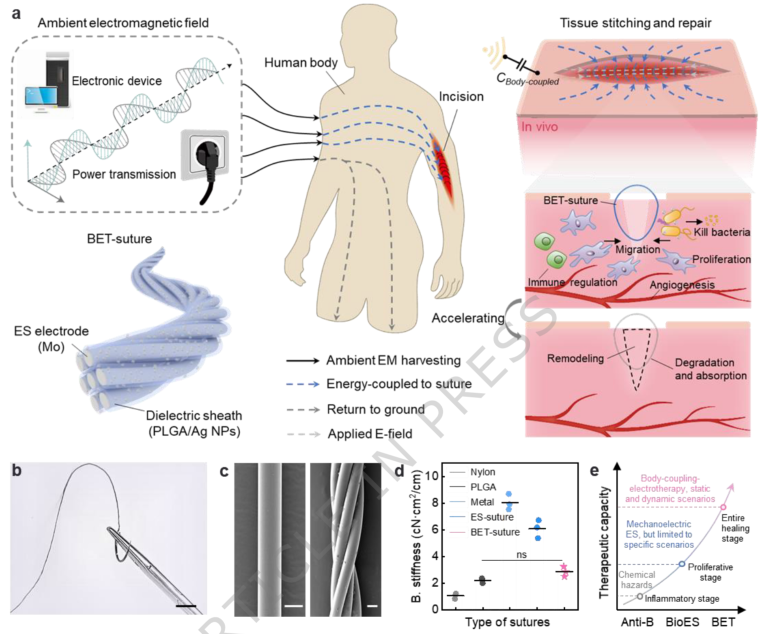
在临床手术中,缝合线是闭合伤口、促进愈合的关键医疗器械。然而,传统缝合线大多仅具备机械闭合功能,缺乏主动调节愈合过程的能力。尽管智能凝胶、电子贴片等先进敷料已在伤口治疗中取得突破,但由于缝合线尺寸微小,在其上集成多功能同时保持可缝合性与力学性能,一直是领域内面临的重大挑战。 长期以来,从化学抗菌缝线到物理电刺激缝线的演进,始终难以实现如其他智能治疗设备般的全面伤口管理。 近期,东华大学侯成义研究员、上海交通大学附属第六人民医院王慧教授、李林鹏老师合作开发出一种可吸收的身体耦合电疗缝合线,为术后伤口管理带来了全新解决方案。该缝合线结合了高强度、柔韧性与可降解性,能够通过转换人体在日常环境中耦合的电磁能量,在伤口部位产生协同电疗作用:介电极化加速抗菌抗炎,介电电压差则促进愈合因子表达。这种全物理方法降低了对银纳米颗粒的依赖,在体外和体内实验中展现出稳定的性能,愈合效率相比单功能缝合线提高1.43倍以上,并有效减少了术后感染。
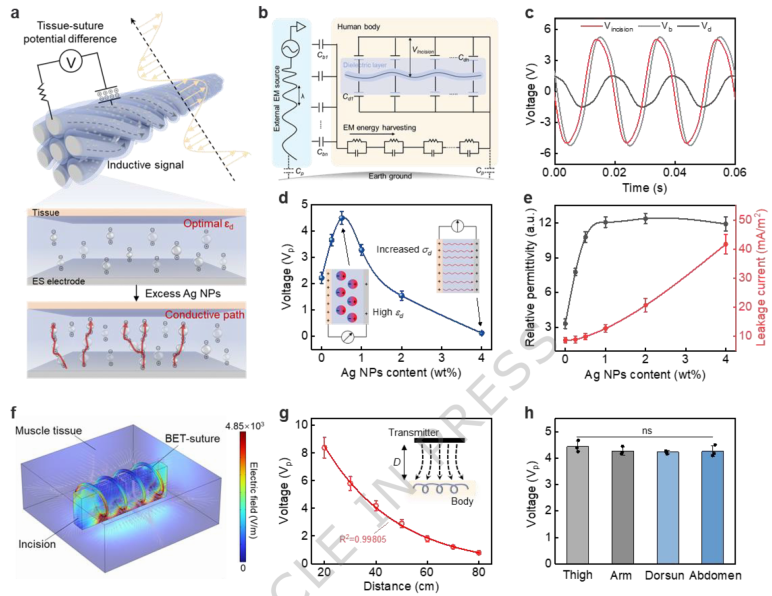
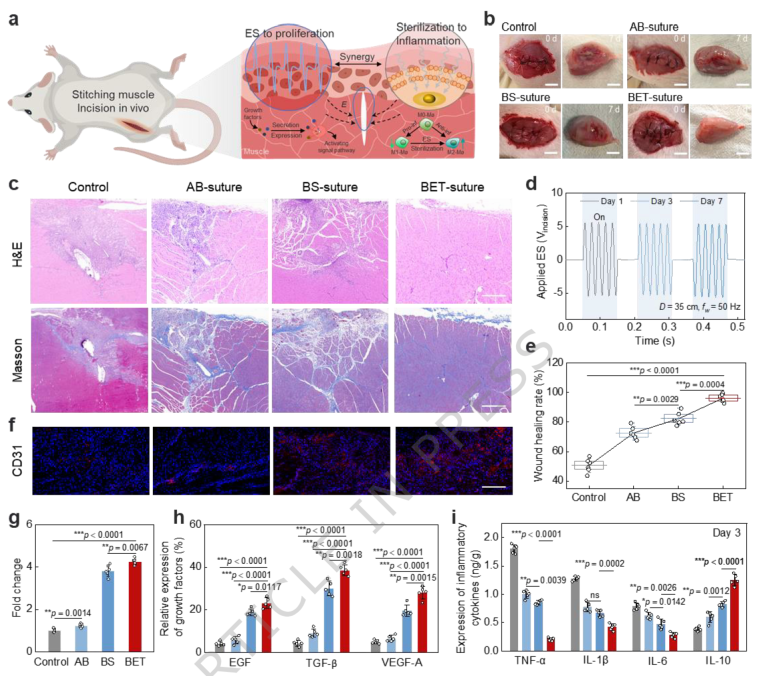
相关论文以“A bioabsorbable body-coupling-electrotherapy suture”为题,发表在Nature Communications上。 研究团队首先通过设计核心为钼丝、鞘层为聚乳酸-羟基乙酸共聚物复合银纳米颗粒的芯鞘纤维,并经过加捻制备出最终的BET缝合线。该缝线不仅直径适中(约201微米),具备优异的拉伸强度(1.52 GPa)和柔韧性(弯曲刚度2.84 cN·cm²/cm),其生物相容性与可吸收性也得到了验证——降解过程中银纳米颗粒释放量远低于安全阈值,且降解产物对细胞无显著毒性。 图1 | 可吸收身体耦合电疗缝合线的设计与原理。 a. BET缝合线促进组织修复过程示意图。缝合线感知并储存来自身体耦合环境的电磁能量,在伤口部位产生电场以执行修复功能。主要作用包括:加速成纤维细胞迁移和增殖、抑制细菌生长;促进血管生成、下调免疫细胞活性、改善组织重塑。b. BET缝合线的光学照片。比例尺:2 cm。c. 初级纤维(左)和BET缝合线(右)的SEM图像。比例尺:60 μm。n = 3个独立样本。d. 不同类型缝合线的弯曲刚度。n = 3个独立样本。e. 缝合线技术的发展脉络——从抗菌化学缝合线到自供电电刺激缝合线,再到当前使用的身体耦合电疗缝合线。 在作用机制方面,植入体内的缝合线能够耦合周围环境中的电磁能,并通过其介电鞘层储存电荷、形成介电电压差,从而在伤口处建立内源性电场,实现电刺激。研究发现,当银纳米颗粒添加量为0.5 wt%时,介电性能最佳,所产生的切口处电势差峰值可达5.04 V,能够在伤口区域形成0.75-5 V/mm的有效电场,促进细胞行为。 图2 | 基于介电电压差的电刺激机制。 a. 组织-缝合线电势差形成及银纳米颗粒含量对介电层影响的示意图。适量银纳米颗粒增强介电性能,过量添加则会形成导电通路。εd:BET缝合线鞘层的相对介电常数。b. BET缝合线通过身体耦合电磁能实施电刺激的等效电路图。Cb:身体耦合电容;Cd:BET缝合线介电层电容;Cp:身体与大地之间的寄生电容;Vincision:身体与BET缝合线核心层之间的电势差。c. 无线电刺激过程中Vincision、Vb和Vd的实时测量结果。Vb:身体耦合电磁能的开路电压;Vd:BET缝合线核心层的开路电压。d. 不同银纳米颗粒含量下Vincision的峰值电压(Vp)。σd:BET缝合线介电层的电导率。n = 3个独立样本。e. 不同银纳米颗粒含量下介电层的相对介电常数与漏电流密度。n = 3个独立样本。f. BET缝合线在切口部位产生电场强度的有限元模拟。螺旋线代表BET缝合线,矩形代表切口。g. 不同距离下Vincision的Vp。h. 不同部位下Vincision的Vp。n = 3个独立样本。 除电刺激外,该缝合线的鞘层在极化后能储存大量电荷(最高5.07 µC/cm²),赋予其电容性抗菌能力。电荷干扰细菌电子传递,诱导活性氧爆发,从而有效抑制金黄色葡萄球菌和大肠杆菌生长,抗菌效果显著优于单纯电场作用。同时,这种电荷介导的物理抗菌策略避免了过量银纳米颗粒可能带来的生物毒性。 图3 | 基于电容特性的电荷增强抗菌效应。 a. BET缝合线的抗菌机制示意图。极化后的介电层激发细菌与缝合线表面之间的瞬时电子转移。巨大的电子损失与银纳米颗粒的作用诱导细菌内活性氧爆发,实现抗菌性能。b. 测量介电层电荷存储能力的实验装置示意图。c. 储存电荷与时间的关系。有效电压5 Vrms,频率50 Hz。d. 极化前后介电层表面电位的KPFM图像。比例尺:30 μm。n = 3个独立样本。e. 经未通电BET缝合线、不含银纳米颗粒的通电BET缝合线、通电BET缝合线及0.1 mM H₂O₂处理后的金黄色葡萄球菌和大肠杆菌的活/死染色及ROS染色图像。比例尺:50 μm。f. 活/死染色结果的定量分析。g. 处理细菌的ROS荧光强度。n = 3个独立样本。 进一步研究确定了电刺激的有效强度窗口:0.75 V/mm为激活细胞钙离子内流、启动修复行为的最低阈值,而超过5 V/mm则可能抑制细胞迁移甚至导致损伤。在有效刺激范围内,电场可通过激活电压门控钙通道,进而上调PI3K/AKT和ERK信号通路磷酸化,促进细胞周期蛋白表达,加速成纤维细胞增殖、迁移及相关生长因子分泌。 图4 | 电刺激强度阈值与细胞信号通路。 a. 将当前主流电刺激技术(包括i) 直接能量供给电刺激,ii) 超声驱动电刺激,iii) 机电转换电刺激)与本工作开发的iv) 无线电信刺激原理进行比较。b. BET缝合线施加不同强度电场的体外实验装置示意图。中间插图显示了通过BET缝合线电极产生的电场分布的有限元模拟结果。c. 划痕愈合实验24小时后的显微图像及细胞增殖实验72小时后的Ki67荧光染色图像。比例尺:80 μm。n = 3个独立样本。d. 细胞内钙离子探针相对荧光强度随施加电刺激电压的变化曲线。n = 3个独立样本。e. 成纤维细胞在0至140 mV施加电压的电刺激作用后,活化的钙离子荧光探针的代表性荧光图像。比例尺:30 μm。n = 3个独立样本。Western blot检测电刺激下成纤维细胞中f) PI3K、AKT和ERK的磷酸化水平,以及g) CCND1和p-CDC2相对于β-actin的相对表达量。n = 3个独立样本。 在动物模型中,BET缝合线展现出全面的愈合阶段调控能力。术后第7天,缝合部位肌肉组织几乎完全愈合,胶原沉积规整,炎症浸润轻微;免疫荧光显示CD31标记的血管生成活跃,而α-SMA标记的肌成纤维细胞活化程度较低,提示修复已进入重塑阶段。此外,伤口组织中促炎因子表达下调、抗炎因子及生长因子表达上调,进一步证实其能快速引导伤口度过炎症期,进入增殖与重塑阶段。 图5 | 体内切口愈合效果评估。 a. BET缝合线基于电刺激和电容抗菌协同辅助体内切口修复的示意图。b. 各组缝合第7天后切口及其周围肌肉组织的光学照片。比例尺:2 cm。c. 各组切口及其周围组织的H&E和Masson染色图像。比例尺:500 μm。n = 6个独立样本。d. 缝合7天内连续监测的Vincision实时信号。e. 通过切片染色计算的各组伤口愈合率。f. 各组愈合组织的CD31免疫荧光染色图像及其g) 定量分析。比例尺:200 μm。n = 6个独立样本。h. 切除组织的生长因子(EGF、TGF-β、VEGF-A)免疫组化染色结果定量分析。n = 5个独立样本。i. 缝合3天后伤口组织的细胞因子(TNF-α、IL-1β、IL-6、IL-10)表达水平。n = 5个独立样本。 这项研究首次报道了一种集伤口固定、全阶段愈合调控、可持续性与低能耗于一体的身体耦合电疗缝合线。它不仅能通过无线能量转换实现稳定电刺激,还兼具物理抗菌与免疫调节功能,在多种术后场景中均表现出优越的临床潜力。未来,该技术有望推广至更多组织与器官的伤口修复,推动智能外科缝合线的临床转化。